El desarrollo del pez cebra

Autores: Andrea Etchartea, Alicia Soza, Isabella Benvenuto, Gabriela del Puerto Mónica González Lario, Verónica Gargiulo, Zully Bornia, Daniel Rodríguez-Ithurralde[1]
Taller desarrollado en el Laboratorio de Neurociencia Molecular del Instituto de Investigaciones Biológicas Clemente Estable (IIBCE).
PRESENTACIÓN
El estudio del desarrollo embrionario de vertebrados nos ofrece importantes indicios de cómo se va generando la organización anatómica y funcional del ser adulto. Muchas veces nos permite, además, explicar cómo se producen algunas enfermedades o malforma-ciones.
¿POR QUÉ EL PEZ CEBRA?
El pez cebra (Danio rerio), banderita o zebrafish (ZF) es muy utilizado en investigación básica y aplicada, debido a que, entre muchas otras virtudes, sus embriones son transparentes y se desarrollan fuera del cuerpo de la madre, permitiendo seguir en el estereomicros-copio, las transformaciones morfoló-gicas y funcionales que ocurren en su cuerpo desde el primer minuto postfecundación.
PROCEDIMIENTOS EXPERIMENTALES
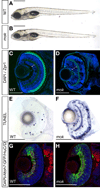
Se emplearon los distintos aumentos de un estereomicroscopio para observar y describir las características morfológicas y fisiológicas normales de huevos, embriones y larvas vivas (en 3-D) y ver la respuesta a distintos estímulos (luz, temperatura, fármacos, etc.) en función del tiempo (4-D). Se reconocieron los distintos estadíos evolutivos, y se compararon con una tabla estándar (Kimmel, 1995). Se puso especial atención en la aparición y modificaciones de las placodas ópticas y óticas, a partir de las 24 hpf. Algunos de los ejemplares fueron anestesiados con hidrato de cloral y fijados con paraformaldehído al 4 % y otros fijadores, con el fin de preservar sus tejidos. El material fue luego sometido a técnicas histológicas que pusieron en evidencia, en forma diferencial, distintos componentes o células del organismo (técnicas de impregnación argéntica, de inmunofluorescencia, etc.) y observado con el microscopio óptico, confocal y/o electrónico de transmisión, de acuerdo a los procedimientos usuales en el IIBCE.
RESULTADOS OBTENIDOS:
I.- IDENTIFICACIÓN DE LAS PRINCIPALES ETAPAS DEL DESARROLLO
Desarrollo temprano
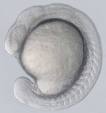
El desarrollo se inició con la segmentación (divisiones celulares sucesivas) del huevo fecundado, con un rápido incremento del número de células. Fue seguida por la gastrulación, caracterizada por movimientos morfogenéticos que reorganizan las células primero en dos y luego en tres capas: ectodermo, endodermo y mesodermo, dando origen a los distintos órganos y sistemas del adulto.
Neurulación
Es el proceso que conduce a la formación del tubo neural, que luego dará origen a las distintas regiones del sistema nervioso central. Esta fase no la observamos en preparados.
Embrión somítico
Se caracteriza por la segmentación del mesodermo en bloques llamados somites. A partir de estos somites se formará el esqueleto, músculos y dermis de las distintas regiones del cuerpo. Observamos esta etapa en la cual comienzan a desarrollarse los órganos internos de los distintos aparatos y se produce un importante desarrollo diferencial de distintas regiones del sistema nervioso. Este período se extiende hasta las 24 hpf.
Eclosión
Comprobamos que entre las 48 -72 se rompe la membrana coriónica y se libera la larva al medio circundante. Conservaron aún por unos días cierta cantidad de vitelo, con el cual se nutre los primeros cuatro días.
Período larvario
En este estadío continuó la formación de órganos primarios, los cartílagos de la cabeza y las aletas. Observamos los latidos cardíacos, la circulación sanguínea, los movimientos corporales y diversas respuestas a estímulos mecánicos.
Juvenil
Presentaron la mayoría de las características del adulto, pero en individuos de menor tamaño.
Adulto
Se considera adulto a partir de los tres meses, período en que alcanza la madurez sexual y comienzan a observarse con más claridad las diferencias morfológicas entre macho y hembra (dimorfismo sexual).
II.- Desarrollo de los sistemas sensoriales
Luego de abordar el desarrollo general de estos peces, profundizamos en su relacionamiento con el mundo circundante, usando como modelo a los sistemas sensoriales.
El universo sensorial de los peces es totalmente diferente al nuestro
“Los peces tienen excelentes sentidos de la vista y olfato y un exclusivo sistema de la línea lateral, que con exquisita sensibilidad detecta corrientes de agua y vibraciones proporcionando un tacto a distancia en el agua” (Hickman, 2009). A partir de las primeras 24 hpf observamos con el microscopio estereoscópico, la aparición y desarrollo de las placodas ópticas y óticas, las cuales dan lugar a la formación de los ojos y los oídos, respectivamente.
Una sensibilidad especial para vertebrados acuáticos.
La densidad del agua la hace un excelente conductor de vibraciones. No sorprende que los organismos acuáticos puedan detectar estas señales mecánicas (vibraciones) por distintas mecanismos de mecano-recepción, que aparecen muy temprano en la historia de los vertebrados y han sido altamente modificados y especializados en los peces (Helfman, 2009).
La mecanorecepción implica la detección de movimientos del agua donde vive el pez. Los peces tienen dos grandes sistemas mecanosensoriales: el sistema de la línea lateral y el oído interno. Ambos se basan en las células sensoriales pilosas las cuales contienen un penacho de prolongaciones parecidas a cilias en su superficie apical (Hickman, 2009; Kardong, 2006; Helfman, 2009).
Con técnicas inmunohistoquímicas logramos observar los trayectos neurales correspondientes a la inervación de los canales cefálicos y corporales del sistema de la línea lateral, tal como se ve coloreado de rojo en la figura.
CONCLUSIONES Y PERSPECTIVAS
Se realizó la observación, registro y fotografía de embriones, larvas y adultos del pez cebra a través de las distintas etapas del desarrollo.
En lo referente al desarrollo de los órganos sensoriales, visualizamos los esbozos de los mismos. La temprana aparición de las placodas óptica y óticas, y su importante tamaño en relación con otras estructuras, permitió comprender la importancia de estos órganos para tempranos requerimientos ambientales y para la supervivencia en la etapa larvaria, por ejemplo.
En lo que respecta al sentido de la línea lateral, tan característico de los peces, comprobamos la abundancia en la región cefálica de los receptores sensoriales denominados neuromastos, viendo su distribución en distintos territorios.
En cuanto a las repercusiones de esta instancia semi-presencial, podemos afirmar que permitió un crecimiento en lo disciplinar de los participantes, y la comprobación de la utilidad de la enseñanza basada en la evidencia, en lo pedagógico. Tuvimos la oportunidad de manejar diferentes recursos y hacerlo en grupo. El trabajo en taller permitió desarrollar nuevas estrategias, haciendo del intercambio de ideas y del trabajo conjunto una forma de enriquecimiento profesional.
El éxito de las jornadas nos obliga a plantearnos la necesidad de integrar experiencias como éstas en el desarrollo del currículo.
“Todo el mundo parece estar de acuerdo que para los jóvenes de hoy,
es importante saber algo del mundo de la ciencia y que es tarea de la escuela
garantizar que esto ocurra.”
Guy Claxon 1
Bibliografía
Claxton, G. (1991). Educar mentes curiosas. Ed. Visor: Madrid.
Helfman, G. (2009). The diversity of fishes. Wiley-Blackwell: London.
Hickman, F. (2009). Principios generales de zoología. 13ª Edición. McGraw-Hill: Barcelona.
Kimmel, Ch. and Ballard, W. (1995). The stages of embryonic development of the zebrafish. Developmental Dynamics, 203: 253-310.
[1] Dirigir toda correspondencia a Dr. Daniel Rodríguez-Ithurralde, Lab. de Neurociencia Molecular, IIBCE - Av. Italia 3318, Montevideo – E-mail: drit@iibce.edu.uy – httm://www.iibce.edu.uy/NMOLF/index.html